Laboratorium Chemii Biofizycznej

15 07 2022
O Grupie
W tematyce badawczej Laboratorium Chemii Biofizycznej zawartych jest kilka obszarów przenikania się chemii, biologii i fizyki, a mianowicie:
- Biologiczna „Soft Matter”: relacje między strukturą i dynamiką biopolimerów, zwłaszcza białek, z ich makroskopowymi właściwościami fizykochemicznymi. Zastosowanie modyfikowanych fizykochemicznie białek jako nowych, funkcjonalnych bionanomateriałów;
- Fizykochemiczne i molekularne podstawy chorób konformacyjnych, agregacją i amyloidogenezą białek; problem jednoznaczności kodowania informacji strukturalnej w propagacji amyloidu; egzotyczne struktury beta-kartkowe;
- Nieanfinsenowskie zachowanie się białek: efekt pamięci konformacyjnej i zjawisko chiralnej bifurkacji jako przykłady wybitnie nierównowagowych procesów towarzyszących nieprawidłowemu zwijaniu się polipeptydów i białek;
- Zastosowanie spektroskopii optycznej (w szczególności spektroskopii oscylacyjnej oraz elektronowego dichroizmu kołowego) do badania przemian strukturalnych biomakromolekuł.
Zainteresowania badawcze:
- Agregacja insuliny;
- Oddziaływania białko-rozpuszczalnik;
- Supramolekularna chiralność białek;
- Amyloidy;
- Oddziaływania elektrostatyczne w białkach.
Aparatura badawcza:
| Nazwa aparatu | Kontakt do operatora/pokój | |
| 1 | Spektrometr FT-IR Nicolet iS50 FT-IR firmy Thermo Fisher Scientific wyposażony w detektor DTGS | wdzwolak@chem.uw.edu.pl / 1.04 |
| 2 | Spektrofluorymetr FLS980 firmy Edinburgh Instruments | wdzwolak@chem.uw.edu.pl / 1.04 |
| 3 | Spektropolarymetr (CD/ORD) J-815 S firmy Jasco | wdzwolak@chem.uw.edu.pl / 1.04 |
Kierownik grupy:
Absolwent Wydziału Chemii UW (1996 – MSc) oraz Uniwersytetu Ritsumeikan w Kioto (2000 – PhD). Autor ponad 90 prac z zakresu biofizyki i chemii fizycznej białek. Laureat m.in. Nagrody Wydziału III PAN w roku 2008; Kierownik i uczestnik szeregu projektów badawczych krajowych i międzynarodowych. Prowadzone przez Wojciecha Dzwolaka badania (również we współpracy z czołowymi ośrodkami naukowymi m.in. w Japonii, Niemczech i USA) skupiają się na szeroko rozumianym problemie kontroli termodynamicznej samoorganizujących się nienatywnych struktur biopolimerowych.
Najważniejsze publikacje:
Puławski W, Dec R, Dzwolak W „Clues to the Design of Aggregation-Resistant Insulin from Proline Scanning of Highly Amyloidogenic Peptides Derived from the N-Terminal Segment of the A-Chain” Mol. Pharm. 21 (2024) 2025–2033.
Dec R, Dzwolak W, Winter R „From a Droplet to a Fibril and from a Fibril to a Droplet: Intertwined Transition Pathways in Highly Dynamic Enzyme-Modulated Peptide-Adenosine Triphosphate Systems” J. Amer. Chem. Soc. 146 (2024) 6045–6052.
Fortunka M, Dec R, Puławski W, Guza M, Dzwolak W “Self-Assembly of Insulin-Derived Chimeric Peptides into Two-Component Amyloid Fibrils: The Role of Coulombic Interactions” J. Phys. Chem. B 127 (2023) 6597-6607.
Dec R, Jaworek M W, Dzwolak W, Winter R „Liquid-Droplet-Mediated ATP-Triggered Amyloidogenic Pathway of Insulin-Derived Chimeric Peptides: Unraveling the Microscopic and Molecular Processes” J. Amer. Chem. Soc. 145 (2023) 4177–4186.
Puławski W, Dzwolak W “Virtual Quasi-2D Intermediates as Building Blocks for Plausible Structural Models of Amyloid Fibrils from Proteins with Complex Topologies: A Case Study of Insulin” Langmuir 38 (2022) 7024–7034.
Wacławska M, Nieznanska H, Dzwolak W „Enzymatic digestion of luminescent albumin-stabilized gold nanoclusters under anaerobic conditions: clues to the quenching mechanism” J. Mater. Chem. C 10 (2022) 3775–3783.
Dec R, Puławski W, Dzwolak W „Selective and stoichiometric incorporation of ATP by self-assembling amyloid fibrils” J. Mater. Chem. B 9 (2021) 8626–8630.
Hernik-Magoń A, Puławski W, Fedorczyk B, Tymecka D, Misicka A, Szymczak P, Dzwolak W „Beware of Cocktails: Chain-Length Bidispersity Triggers Explosive Self-Assembly of Poly-L-Glutamic Acid β2-Fibrils” Biomacromolecules 17 (2016) 1376–1382.
Piejko M, Dec R, Babenko V, Hoang A, Szewczyk M, Mak P, Dzwolak W “Highly Amyloidogenic Two-chain Peptide Fragments Are Released upon Partial Digestion of Insulin with Pepsin” J. Biol. Chem. 290 (2015) 5947–5958.
Surmacz-Chwedoruk W, Nieznańska H, Wójcik S, Dzwolak W, “Cross-Seeding of Fibrils from Two Types of Insulin Induces New Amyloid Strains” Biochemistry 51 (2012) 9460–9469.
Fulara A, Lakhani A, Wójcik S, Nieznaska H, Keiderling TA, Dzwolak W, “Spiral Superstructures of Amyloid-Like Fibrils of Polyglutamic Acid: An Infrared Absorption and Vibrational Circular Dichroism Study” J. Phys. Chem. B 115(2011) 11010–11016.
Loksztejn A, Dzwolak W, “Vortex-Induced Formation of Insulin Amyloid Superstructures Probed by Time-Lapse Atomic Force Microscopy and Circular Dichroism Spectroscopy” J. Mol. Biol. 395 (2010) 643–655.
Dzwolak W, Loksztejn A, Galinska-Rakoczy A, Adachi R, Goto Y, Rupnicki L, “Conformational indeterminism in protein misfolding: chiral amplification on amyloidogenic pathway of insulin” J. Amer. Chem. Soc. 129 (2007) 7517-7522.
Dzwolak W, Ravindra R, Nicolini C, Jansen R, Winter R “The Diastereomeric Assembly of Polylysine Is the Low-Volume Pathway for Preferential Formation of b-Sheet Aggregates” J. Amer. Chem. Soc. 126 (2004) 3762-3768.
Szczególne osiągnięcie:
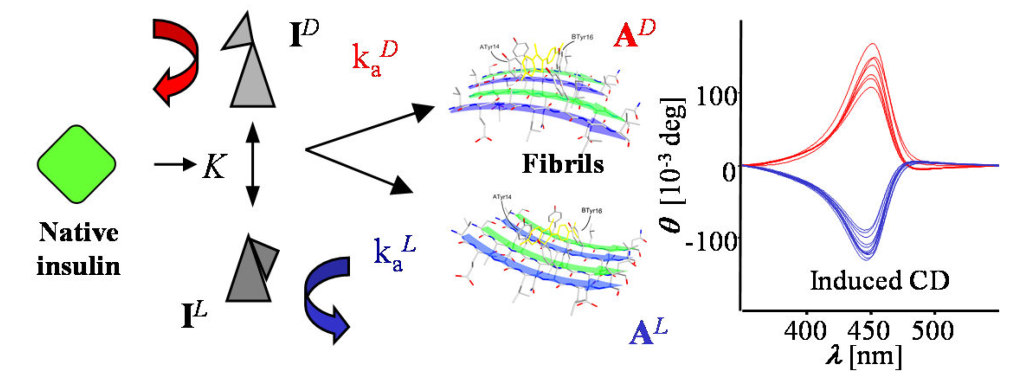
Odkrycie zjawiska chiralnej bifurkacji w agregacji insuliny polegającego na stochastycznym wyborze jednego z dwóch typów chiralnych superstruktur amyloidu insuliny o odmiennych właściwościach chiralooptycznych. Zjawisko to stanowi unikalny w biofizyce molekularnej przypadek łamania symetrii. (Dzwolak et al. J. Amer. Chem. Soc. 129 (2007) 7517-7522)