Laboratorium badania lekowrażliwości oraz mechanizmów oporności na antybiotyki

02 09 2022
O Grupie
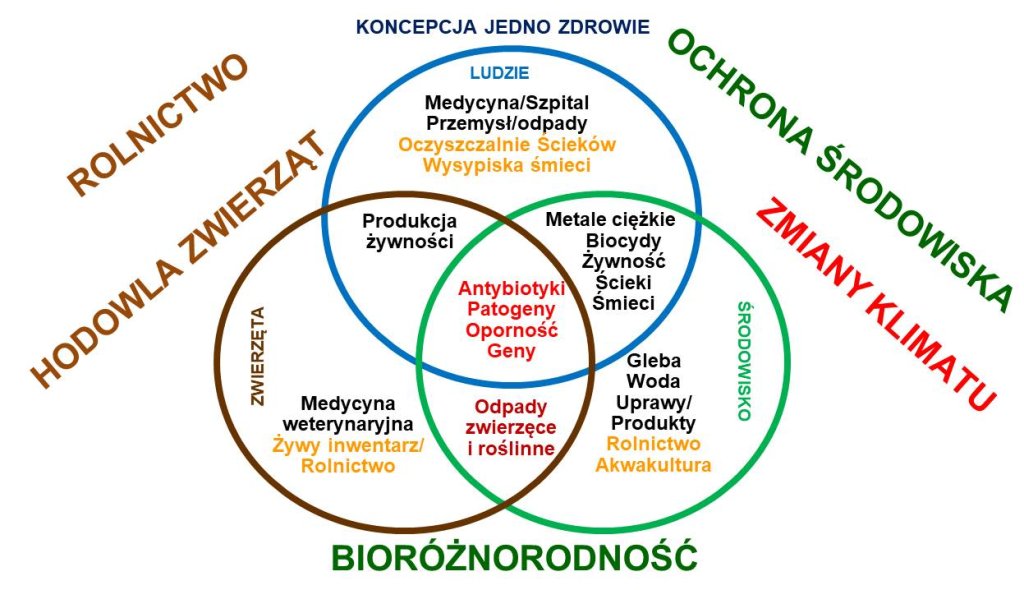
Międzynarodowa Organizacja Zdrowia uzgodniła, że rozwiązanie problemu oporności na środki przeciwdrobnoustrojowe wymaga holistycznego podejścia, w którym istotne jest powiązanie i wzajemne oddziaływanie na siebie trzech sfer: ludzkiej, weterynaryjnej i środowiskowej. To tak zwane podejście oparte na jednym zdrowiu „One Health”, gdzie zdrowie człowieka jest powiązane ze zdrowiem zwierząt oraz stanem środowiska, silnie odnosi się do związku różnorodności biologicznej i zdrowia środowiska. Grupa prowadzi badania zgodnie z tym podejściem z zakresu mikrobiologii, fizjologii i genetyki bakterii oraz biotechnologii.
Grupa współpracuje z zespołami z Austrii, Francji, Irlandii, Izraela, Kanady, Niemiec, Rumuni i Szwajcarii w ramach dwóch projektów międzynarodowych, których koordynatorem w Polsce jest prof. M. Popowska:
- 2018-2022, INART – Intervention of antimicrobial resistance transfer into the food chain, (JPIAMR).
- 2020-2023, ANTIVERSA – Biodiversity as an ecological barrier for the spread of clinically relevant antibiotic resistance in the environment (BiodivERsA Call 2018).
Oraz z zespołami badawczymi z Włoch (Uniwersytet Mediolański), jaki z zespołami z Uniwersytetu Gdańskiego i Gdańskiego Uniwersytety Medycznego, których koordynatorem jest dr. M. Hejna:
2025-2028: SONATA20, MARINA-CARE: Novel Marine-derived Anti-inflammatory, antioxidant and antibacterial Replacement Ingredients: Nutraceuticals as preventative Alternatives in Commercial Animal REaring systems.
Wykorzystujemy: szeroki zakres technik mikrobiologicznych, analitycznych, fizjologicznych, biochemicznych, molekularnych, metagenomicznych i bioinformatycznych oraz specjalistyczną aparaturę, m.in.: termocyklery, Real-Time PCR System, ARG Smart Chips, epicPCR, wielodetekcyjny czytnik SpectraMax iD3.
Działalność badawcza
Zespół zajmuje się głównie badaniami dotyczącymi mechanizmów oporności bakterii środowiskowych lub endofitycznych na antybiotyki i metale ciężkie. Skupiamy się na badaniu bakterii opornych na antybiotyki (ARB), określaniu profilu lekowrażliwości oraz identyfikacji genów oporności (ARG) zlokalizowanych głównie na ruchomych elementach genetycznych takich jak plazmidy, które mogą być rozpowszechniane w danym środowisku na drodze horyzontalnego transferu genów (HGT). Przedmiotem badań są bakterie izolowane ze środowiska naturalnego, z gleby, płodów rolnych, wody, stawów hodowlanych, oczyszczalni ścieków, odchodów zwierzęcych: kurzych, świńskich i bydlęcych. W tym kontekście analizujemy też skład mikrobiomu ww. środowisk oraz badamy ich właściwości fizykochemiczne (FCH), co pozwala nam określić istniejące korelacje między bioróżnorodnością, wł. FCH a występowaniem ARG.
Przeprowadzone do tej pory badania dotyczyły charakterystyki bakterii opornych na antybiotyki bytujących w produktach spożywczych a także z oczyszczalni ścieków na wszystkich etapach oczyszczania oraz identyfikacji ich mechanizmów oporności wraz z analizą plazmidów oporności. Zbadano również metagenom i rezystom gleb ornych oraz odchodów zwierzęcych (zakończony w 2022 roku projekt międzynarodowy INART). Aktualnie badania prowadzone są w ramach projektu międzynarodowego: ANTIVERSA, którego celem jest sprawdzenie postawionej hipotezy, że trwałość, a zatem i liczebność i różnorodność klinicznie istotnych ARG i ARB jest odwrotnie skorelowana z różnorodnością biologiczną społeczności danego środowiska, do którego są one wprowadzane, postulując zatem istotną rolę rodzimego mikrobiomu, jako naturalnej bariery dla rozprzestrzeniania się oporności na antybiotyki.
Dodatkowym aspektem prowadzonych badań jest:
– poszukiwanie specyficznych związków przeciwbakteryjnych wytwarzanych przez bakterie i grzyby jako możliwej alternatyw dla leków w zwalczaniu bakterii patogennych;
– ocena właściwości przeciwbakteryjnych wybranych związków fitoaktywnych. W szczególności analizujemy wpływ fitoskładników obecnych w ekstraktach z glonów na hamowanie wzrostu patogennych szczepów bakterii w hodowlach płynnych, wrażliwość szczepów na te ekstrakty, przeżywalność komórek bakteryjnych oraz zdolność ekstraktów do hamowania tworzenia biofilmu. Analizujemy również te fitoskładniki pod względem ich właściwości przeciwzapalnych i antyoksydacyjnych.
Usługi badawcze
- Badania wrażliwości na środki przeciwbakteryjne oraz identyfikacja szczepów opornych (metoda disk diffusion – krążkowo-dyfuzyjna; E-testy; z wykorzystaniem systemu VITEK, BioMerieux)
- Badania mechanizmów oporności: identyfikacja genów oporności na antybiotyki, chemioterapeutyki i metale ciężkie (amplifikacja PCR- termocyklery; qPCR – Real-Time PCR LightCycler 96, Roche; ARG Smart Chips, Takara; epicPCR – mikroskop fluorescencyjny VisiScope®)
- Identyfikacja plazmidów oporności, koniugacja; transformacja; klonowanie DNA (z wykorzystaniem klasycznych metod biologii molekularnej oraz systemów do amplifikacji i wizualizacji produktów amplifikacji PCR)
- Konstrukcja wektorów genetycznych i szczepów markerowych
- Hodowla mikroorganizmów, otrzymywanie czystych kultur bakterii oraz ich identyfikacja (podłoża selekcyjne, markery molekularne, 16S rRNA PCR oraz V3-V4 16S rRNA targetowany metagenom, oraz identyfikacja z wykorzystaniem MALDI-TOF MS)
- Badania bioróżnorodności (metagenom, rezystom, analizy bioinformatyczne)
- Badania powstawania biofilmów bakteryjnych, kinetyka wzrostu bakterii (m.in. z wykorzystaniem wielodetekcyjnego czytnik płytek SpectraMax iD3 – Molecular Devices)
- Badanie występowania związków bioaktywnych, takich jak flawonoidów, polifenoli i barwników w ekstraktach roślinnych (ekstrakcja z użyciem homogenizatora FastPrep-24, MP Biomedical oraz wyparki próżniowej IKA RV3; z użyciem wielodetekcyjnego czytnika płytek SpectraMax iD3).
- Badania związków bioaktywnych pochodzenia roślinnego pod względem ich właściwości przeciwbakteryjnych (metoda disk diffusion; z wykorzystaniem systemu VITEK, BioMerieux).
- Badania mechanizmów obronnych w komórkach eukariotycznych, oznaczanie cytokin (hodowla z wykorzystaniem inkubatora Heracell 150i, ThermoFisher).
- Badanie właściwości antyoksydacyjnych związków roślinnych metodą kolorymetryczną (z użyciem wielodetekcyjnego czytnika płytek SpectraMax iD3).
O KIEROWNIKU
dr hab. Magdalena Popowska, prof. ucz.
Kierownik Zakładu Fizjologii Bakterii w Instytucie Mikrobiologii UW. Przewodnicząca Rady Naukowej Dyscypliny – Nauki Biologiczne UW w pierwszej i drugiej (obecnej) kadencji 2021-2024. Dyrektor Instytutu Mikrobiologii w kadencji 2016-2020. Kierownik Studiów Podyplomowych Ochrony Środowiska (od 2012 roku). Prezes spółki biotechnologicznej BACTrem typy spin-out UW od 2016 roku. Prowadzi badania z zakresu biotechnologii, mikrobiologii, fizjologii i genetyki bakterii w ramach licznych projektów krajowych i międzynarodowych. Autor ponad 60 publikacji i kilkudziesięciu doniesień konferencyjnych oraz patentów. Beneficjent wielu nagród i wyróżnień za dorobek naukowy, dydaktyczny, publikacje i patenty. Oficjalny reprezentant Polski w międzynarodowych akcjach COST dotyczących antybiotykooporności: NEREUS – ES1403 i DARE – TD0803 oraz Network – JPIAMR – WAWES dotyczący bioróżnorodności. Laureatka: 2019 – X edycji konkursu Bizneswoman Roku w kategorii Liderka w Nowych Technologiach; 2020 – Polskiej Nagrody Inteligentnego Rozwoju jako Naukowiec przyszłości; 2022 – nagrody gospodarczej „AMBASADOR INNOWACYJNOŚCI” przyznanej przez Europejski Ośrodek Rozwoju Gospodarki w uznaniu za zasługi oraz wybitne zaangażowanie w liczne projekty, mające na celu rozwój innowacji w Polsce, przyszłościowe, nieszablonowe myślenie oraz nowe rozwiązania.